胰腺导管腺癌(pancreatic ductal adenocarcinoma,pdac)是一种高度转移性疾病,所有的靶向和免疫疗法都很难治愈。尽管pdac的早期诊断以及治疗方法取得了进展,但由于早期诊断时,甚至在进行手术治疗之后,发生远端转移的几率很高,所以pdac患者的预后极差。肿瘤内部的高度异质性以及复杂的肿瘤微环境被广泛认为是有效治疗pdac患者的主要障碍。由于大多数pdac 患者的转移组织无法通过手术切除获得,这些研究只通过内镜超声引导下细针穿刺抽吸术(endoscopic ultrasound-guided fine needle aspiration,eus- fna) 收集有限的转移组织活检,因此阻碍了对转移性pdac的整个肿瘤微环境的综合理解和评估。
南京大学吕瑛等研究人员对4名经病理诊断为pdac并伴有肝转移的患者的8个新鲜组织进行了单细胞转录组测序,并且对公共数据库进行了深入挖掘。
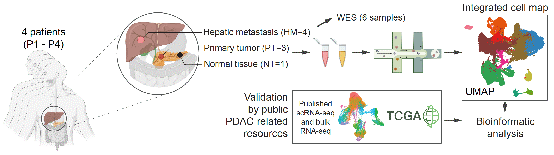
研究人员首先对上皮细胞进行了深入的分析,通过重新聚类分析,得到了6个上皮细胞亚群。发现第0簇ecs(rps3 )主要存在于正常组中,而其他四个亚群主要存在于肿瘤组织中。通过染色体拷贝数变异分析发现在正常组织中几乎没有观察到cnv事件,而转移组cnv水平最高,并且每个上皮细胞亚群中cnvhigh细胞的百分比与该群中hm细胞的百分比呈正相关。与tcga数据库联合分析发现,第2簇(ceacam6 )和第3簇(ceacam5 )上皮细胞亚群是恶性程度较高的细胞群。
研究人员进一步探索了pdac患者的胰腺上皮细胞从原发肿瘤到转移肿瘤的分化动态,即轨迹①:从pt组织的高增殖但低cnv状态到hm组织的恶性且cnvhigh状态。并且,发现了一个促进pdac进展和转移的恶性基因集,如klk7、litaf 和sprr1b。
研究人员后续对基质细胞和免疫细胞也展开了深入的分析,确定了几个基质细胞和免疫细胞的特定亚型,包括rgs5 肿瘤相关成纤维细胞、ccl18 脂质相关巨噬细胞、s100a8 中性粒细胞和foxp3 调节性t细胞,对肝转移肿瘤中促肿瘤微环境的形成至关重要。细胞相互作用分析进一步显示,转移性组织中缺乏肿瘤-免疫细胞的相互作用,有助于形成免疫抑制性微环境。
综上,该研究首次绘制了同步切除的胰腺导管腺癌原发肿瘤和与之相匹配的肝转移瘤的单细胞转录组图谱,发现了上皮细胞在肝转移肿瘤中表现出与原发肿瘤不同的转录组特征,并且从原发肿瘤到肝转移肿瘤有明确的分化轨迹;确定了几个基质细胞和免疫细胞的特定亚型对肝转移肿瘤中促肿瘤微环境的形成至关重要;发现了几个可能与pdac转移和不良预后相关的新型标志物,如klk7、litaf 和sprr1b;细胞相互作用分析进一步显示,转移性组织中缺乏肿瘤-免疫细胞的相互作用,有助于形成免疫抑制性微环境。
2023年08月23日,南京大学医学院附属鼓楼医院吕瑛教授、邹晓平教授同生命科学学院陈迪俊教授、闫超教授合作在nature communications杂志在线发表了题为single cell transcriptomic analyses implicate an immunosuppressive tumor microenvironment in pancreatic cancer liver metastasis的研究论文。该研究对pdac配对的原发性和转移性肿瘤样本的肿瘤微环境中不同细胞成分和功能表型进行了全面的描述,不仅促进了对转移性pdac的免疫抑制微环境机制的深入理解,并可以作为设计新型靶向治疗的宝贵资源,为提高pdac肝转移患者的生存率奠定基础。南京大学医学院附属鼓楼医院消化科吕瑛教授、邹晓平教授、生命科学学院陈迪俊教授、闫超教授为本文的共同通讯作者。南京大学医学院附属鼓楼医院张舒博士、生命科学学院博士生方雯、江苏大学博士生周思琦、苏州大学附属第一医院朱东明主任以及南京大学生命科学学院硕士生陈瑞东为本文的共同第一作者。
